この他,細胞内には,収縮胞とよばれる浸透圧を調節する装置や,細胞口,食胞,細胞肛門といった栄養摂取に関連した細胞内器官がある。また,右図にはないが,細胞膜直下には,トリコシストと呼ばれる特殊な構造がある。トリコシストには特殊なタンパク質が含まれていて,様々な刺激で細胞外へ飛び出す。飛び出すと伸長して槍状構造に変化する(次頁下の写真参照)。防御のため,という説もあるがはっきりした機能はわかっていない。
ゾウリムシは原生生物で最初に性の存在が発見された生物として知られている(Sonneborn 1937)。異なる接合型の細胞が出会うと,やがてお互いに接着して接合対を作る。その中では小核の減数分裂,それによってできた配偶核どうしの融合(=受精)といった有性生殖特有の核変化が起こる。
受精後のゾウリムシには未熟期と呼ばれる接合しない「子供」の時期がある。受精後,一定の細胞分裂を繰り返すと成熟期となり,ふたたび接合ができるようになる。そのまま接合をしないで分裂を続けると,やがて老化してクローン死を起こす。このため,ゾウリムシは老化のしくみを知るためのモデル材料としてもよく利用されている。
ゾウリムシ属の仲間 :ヒメゾウリムシ(Paramecium aurelia complex), ミドリゾウリムシ(P. bursaria),P. multimicronucleatum,P. trichium, P. jenningsi,P. calkinsi,P. duboscqui等
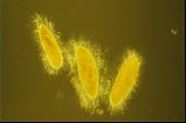
 ゾウリムシの接合 相補的な接合型の細胞(左上下)を混ぜ合わせると ただちに繊毛を介した細胞凝集反応(mating reaction)が 起きる。これが1時間ほど続くとやがて2つの細胞が接着 した接合対ができる。 |
 ゾウリムシとヒト 単細胞か多細胞かという違いを除けば,両者はよく似ている。 |